Class 9th science notes chapter 4 Structure of The Atom (परमाणु की संरचना)
अध्याय 4 परमाणु की संरचना के महत्त्वपूर्ण तथ्य
- इलेक्ट्रॉन की खोज जे . टॉमसन ने की ।
- प्रोटॉन की खोज ई . गोल्डस्टीन ने की ।
- जे . जे . टॉमसन ने यह प्रस्तावित किया था कि इलेक्ट्रॉन धनात्मक गोले में फँसे होते हैं ।
- रदरफोर्ड के अल्फा कणों के प्रकीर्णन प्रयोग ने परमाणु केन्द्रक की खोज की ।
- रदरफोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर बहुत छोटा केन्द्रक होता है और इलेक्ट्रॉन केन्द्रक के चारों ओर घूमते हैं । परमाणु की स्थिरता की इस मॉडल से व्याख्या नहीं की जा सकी है ।
- नील बोर द्वारा दिया गया परमाणु का मॉडल अधिक सफल था । उन्होंने प्रस्तावित किया कि इलेक्ट्रॉन केन्द्रक के चारों ओर निश्चित ऊर्जा के साथ अलग - अलग कक्षाओं में वितरित हैं । अगर परमाणु की सबसे बाहरी कक्षाएँ भर जाती हैं , तो परमाणु स्थिर होगा और कम क्रियाशील होगा ।
- जे . चैडविक ने परमाणु अन्दर न्यूट्रॉन की उपस्थिति को खोजा । इस प्रकार परमाणु तीन अवपरमाणुक कण हैं - इलेक्ट्रॉन , प्रोटॉन और न्यूट्रॉन । इलेक्ट्रॉन ऋण आवेशित होते हैं , प्रोटॉन धनावेशित होते हैं और न्यूट्रॉन अनावेशित होते हैं । इलेक्ट्रॉन का द्रव्यमान हाइड्रोजन परमाणु के द्रव्यमान के 1/2000 गुणा होता है । प्रोटॉन और न्यूट्रॉन में प्रत्येक का द्रव्यमान एक इकाई लिया जाता है ।
- परमाणु के कक्षों को K , L , M , N ........ नाम दिया गया है ।
- संयोजकता परमाणु की संयोजन शक्ति है ।
- एक तत्व की परमाणु संख्या केन्द्रक में विद्यमान प्रोटॉनों की संख्या के बराबर होती है ।
- परमाणु की द्रव्यमान संख्या केन्द्रक में विद्यमान न्यूक्लियानों की संख्या के बराबर होती है ।
- समस्थानिक एक ही तत्व के परमाणु हैं जिनकी द्रव्यमान संख्या भिन्न - भिन्न होती है ।
- समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न - भिन्न होती है ।
- तत्वों को उनके प्रोटॉनों की संख्या के आधार पर परिभाषित किया जा सकता है ।
( B ) क्रियाकलाप क्रियाकलाप 4.1 ( पृष्ठ संख्या 52 )
प्रश्न A. सूखे बालों पर कंघी कीजिए । क्या कंघी कागज छोटे - छोटे टुकड़ों को आकर्षित करती है ?
उत्तर - सूखे बालों पर कंघी करने पर कंघी पर ऋणावेश उत्पन्न हो जाता है क्योंकि बालों से इलेक्ट्रॉन कंघी में स्थानान्तरित जाते हैं । जब कंघी को कागज के छोटे - छोटे टुकड़ों के पास लाया जाता है तो कागज ( जो पहले अनावेशित था ) पर कंघी के पास वाले सिरे पर धनात्मक आवेश उत्पन्न हो जाता है । कागज के दूसरे सिरे पर ऋणात्मक आवेश उत्पन्न होता है । चूँकि विपरीत आवेश एक - दूसरे को आकर्षित करते हैं अत : कागज के टुकड़े कंघी की ओर आकर्षित हो जाते हैं ।
प्रश्न B. काँच की एक छड़ को सिल्क के कपड़े पर रगड़िए और इस छड़ को हवा से भरे गुब्बारे के पास लाइए । क्या होता है , ध्यान से देखिए ।
उत्तर - काँच की छड़ को सिल्क से रगड़ने पर इसमें धनात्मक आवेश उत्पन्न हो जाता है व सिल्क के कपड़े पर ऋणात्मक आवेश उत्पन्न होता है । जब काँच की छड़ को हवा से भरे गुब्बारे के पास लाया जाता है तो यह गुब्बारे को आकर्षित करती है क्योंकि गुब्बारा ऋणावेशित हो जाता है ।
( C ) पाठान्तर्गत प्रश्नोत्तर • प्रश्न श्रृंखला # 01 ( पृष्ठ संख्या 53 )
प्रश्न 1.केनाल किरणें क्या हैं ?
उत्तर - केनाल किरणें धनावेशित विकिरण होती हैं । इनके द्वारा अंततः दूसरे अवपरमाणुक तत्वों की खोज हुई । धनावेशित कणों का आवेश इलेक्ट्रॉनों के आवेश के बराबर किन्तु विपरीत होता है । इनका द्रव्यमान इलेक्ट्रॉनों की अपेक्षा लगभग 2000 गुणा अधिक होता है । इनको प्रोटॉन कहते हैं । केनाल किरणों की खोज ई . गोल्डस्टीन ने 1886 में की ।
प्रश्न 2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है , तो इसमें कोई आवेश होगा या नहीं ?
उत्तर - नहीं , परमाणु पर कोई आवेश नहीं होगा क्योंकि प्रोटॉन व इलेक्ट्रॉन के आवेश संतुलित होंगे । इलेक्ट्रॉन व प्रोटॉन का आवेश एक - दूसरे के बराबर किन्तु विपरीत होता है ।
प्रश्न शृंखला # 02 ( पृष्ठ संख्या 56 )
प्रश्न 1. परमाणु उदासीन है , इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए ।
उत्तर - टॉमसन के परमाणु मॉडल के आधार पर-
( i ) परमाणु धनावेशित गोले का बना होता है और इलेक्ट्रॉन उसमें फँसे होते हैं ।
( ii ) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं । इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं । अत : टॉमसन का मॉडल परमाणु के उदासीन होने की व्याख्या करता है ।
प्रश्न 2. रदरफोर्ड के परमाणु मॉडल के अनुसार , परमाणु के नाभिक में कौन - सा अवपरमाणुक कण विद्यमान है ?
उत्तर - रदरफोर्ड के परमाणु मॉडल के अनुसार , परमाणु के नाभिक में धनावेशित अवपरमाणुक कण विद्यमान है ।
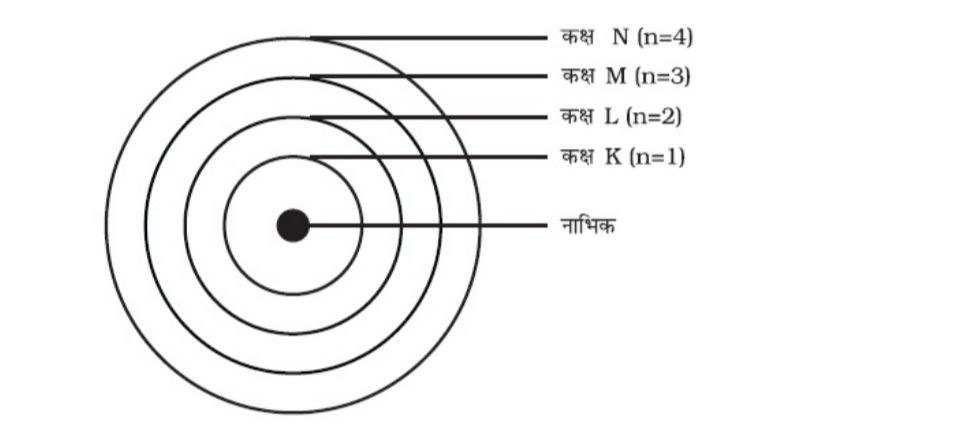
प्रश्न 3. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइये।
उत्तर:
प्रश्न 4. क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से सम्भव होगा ?
उत्तर - यदि अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त किसी दूसरी धातु की पन्नी से किया जायेगा तो प्रयोग सफल नहीं होगा व सटीक निष्कर्ष नहीं निकलेगा । अन्य धातु की परत इतनी पतली नहीं होती । मोटी परत वाली पन्नी लेने पर अधिक अल्फा कण विक्षेपित होंगे व परमाणु में धनावेशित भाग की स्थिति का निश्चित रूप से अनुमान लगाना कठिन होगा ।
प्रश्न श्रृंखला # 03 ( पृष्ठ संख्या 56 )
प्रश्न 1. परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर - परमाणु के तीन अवपरमाणुक कण हैं- इलेक्ट्रॉन , प्रोटॉन एवं न्यूट्रॉन ।
प्रश्न 2. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और इसके नाभिक में दो प्रोटॉन होते हैं । इसमें कितने न्यूट्रॉन होंगे ?
उत्तर - परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग के बराबर होता है ।
हीलियम परमाणु का परमाणु द्रव्यमान = 4u
हीलियम के नाभिक में उपस्थित प्रोटॉन = 2
अत : इसमें उपस्थित न्यूट्रॉन का द्रव्यमान = 4u/2 = 2u
इसमें उपस्थित न्यूट्रॉन = 2
प्रश्न शृंखला # 04 ( पृष्ठ संख्या 57 )
प्रश्न 1. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन - वितरण लिखिए ।
उत्तर - कार्बन परमाणु में कुल इलेक्ट्रॉनों की संख्या 6 है
कार्बन परमाणु में इलेक्ट्रॉन वितरण-
पहला K कोश = 2 इलेक्ट्रॉन
दूसरा L कोश = 4 इलेक्ट्रॉन
या कार्बन परमाणु में इलेक्ट्रॉन वितरण 2 , 4 है ।
सोडियम परमाणु में कुल इलेक्ट्रॉन 11 हैं ।
सोडियम परमाणु में इलेक्ट्रॉन वितरण-
प्रथम K कोश = 2 इलेक्ट्रॉन
दूसरा L कोश = 8 इलेक्ट्रॉन
तीसरा M कोश = 1 इलेक्ट्रॉन
अत : सोडियम में इलेक्ट्रॉन वितरण 2,8 , 1 है ।
प्रश्न 2. अगर किसी परमाणु का K और L कोश भरा है , तो परमाणु में इलेक्टॉनों की संख्या क्या होगी ?
उत्तर-
K कक्ष के लिए अधिकतम इलेक्ट्रॉनों की संख्या = 2×1² = 2
L कक्ष के लिए यह संख्या = 2 × (2)^2 = 8
अत : परमाणु में 10 इलेक्ट्रॉन होंगे ।
प्रश्न श्रृंखला # 05 ( पृष्ठ संख्या 58 )
प्रश्न 1. क्लोरीन , सल्फर और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे ?
उत्तर- यदि किसी परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या 4 या उससे कम है , तो उस तत्व की संयोजकता बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों की संख्या के बराबर होगी यदि परमाणु के बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों की संख्या 4 से अधिक है तो उसकी संयोजकता , बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों की संख्या को 8 में से घटाकर प्राप्त किया जाता है ।
क्लोरीन की परमाणु संख्या = 17
क्लोरीन में इलेक्ट्रॉनों की का वितरण = 2,8,7
अत : क्लोरीन की संयोजकता = 8-7 = 1
सल्फर की परमाणु संख्या = 16
सल्फर में इलेक्ट्रॉनों का वितरण = 2,8,6
अत : सल्फर की संयोजकता = 8-6 = 2
मैग्नीशियम की परमाणु संख्या = 12
मैग्नीशियम में इलेक्ट्रॉनों का वितरण = 2,8,2
अत : मैग्नीशियम की संयोजकता = 2
प्रश्न श्रृंखला # 06 ( पृष्ठ संख्या 59 )
प्रश्न 1. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब , ( a ) परमाणु की परमाणुक संख्या क्या है ? ( b ) परमाणु का क्या आवेश है ?
उत्तर- ( a ) परमाणु की परमाणुक संख्या उसमें उपस्थित प्रोटॉनों की संख्या के बराबर होती है । अत : परमाणु की परमाणुक संख्या 8 है।
( b ) चूँकि इलेक्ट्रॉनों व प्रोटॉनों की संख्या बराबर अतः परमाणु का आवेश शून्य होगा या परमाणु अनावेशित होगा ।
प्रश्न 2. ऑक्सीजन और सल्फर - परमाणु की द्रव्यमान संख्या ज्ञात कीजिए ।
हल :
ऑक्सीजन की द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या = 8 + 8 = 16
सल्फर की द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या = 16 + 16 = 32
प्रश्न श्रृंखला 07 ( पृष्ठ संख्या 60 )
प्रश्न 1. चिह्न H , D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए ।
उत्तर:

प्रश्न 2. समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए ।
उत्तर -
कार्बन के दो समस्थानिकों का इलेक्ट्रॉनिक विन्यास
( D ) पाठान्त प्रश्नोत्तर
प्रश्न 1. इलेक्ट्रॉन , प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए ।
उत्तर :

प्रश्न 2. जे . जे . टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर - जे . जे . टॉमसन का परमाणु मॉडल दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों के परिणामों को नहीं समझा सका । इसको किसी प्रयोग द्वारा स्थापित नहीं किया गया ।
प्रश्न 3. रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर- रदरफोर्ड के परमाणु मॉडल से परमाणु की स्थिरता की व्याख्या नहीं की जा सकती ।
प्रश्न 4. बोर के परमाणु मॉडल की व्याख्या कीजिए ।
उत्तर- नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत की -
( i ) परमाणु का केन्द्र धनावेशित होता है जिसे नाभिक कहा जाता है । एक परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में होता है ।
( ii ) नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है ।
( iii ) नाभिक के चारों ओर इलेक्ट्रॉन कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं , जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं ।
( iv ) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता है । इन कक्षाओं ( या कोशों ) को ऊर्जा स्तर कहते हैं । ये कक्षाएँ ( या कोश ) K , L , M , N ....... या संख्याओं , 1 , 2 , 3 , 4 .... के द्वारा दिखाई जाती है , जैसा कि नीचे चित्र में दिखाया गया है ।
प्रश्न 5. इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए
उत्तर: ( i ) जे.जे. टॉमसन का परमाणु मॉडल : टॉमसन ने परमाणुओं की संरचना से संबंधित एक मॉडल प्रस्तुत किया , जो तरबुज कि तरह था । उन्होंने इसके लिए निम्न मॉडल प्रास्तावित किया ।
( 1 ) परमाणु धनआवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धंसे होते है ।
( 2 ) ऋणात्मक और धनात्मक आवेश परिणाम में समान होते है । इसलिए परमाणु वैद्युतीय रूप से उदासीन होता है ।
( ii ) रदरफोर्ड का परमाणु मॉडल : रदरफोर्ड के परमाणु मॉडल के अनुसार , परमाणु में धनावेशित भाग उसके केंद्र में है जिसे नाभिक कहा जाता है । इस नाभिक में परमाणु का समस्त द्रव्यमान स्थित है । इलेक्ट्रॉन नाभिक के चारों ओर स्थित रिक्त स्थान में चक्कर लगाते हैं । नाभिक का आकार परमाणु के आकार कि तुलना में अत्यंत कम या उपेक्षनीय है । ठीक वैसे ही जैसे एक बड़े से मैदान के बीच में रखा फूटबाल ।
( iii ) बोर का परमाणु मॉडल : इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते है , जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते है । जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते है तो उनकी उर्जा का विकिरण नहीं होता ।
प्रश्न 6. पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए ।
उत्तर - पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के लिए बोर और बरी ने निम्न नियम प्रस्तुत किए
( i ) किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 272 से दर्शाया जाता है , जहाँ । ' कक्षा की संख्या या ऊर्जा स्तर है । इसलिए इलेक्ट्रॉनों की अधिकतम संख्या पहले कक्ष या K कोश में होगी 2 × 1^2 = 2 ,
दूसरे कक्ष या L कोश में होगी = 2 × 2^2 = 8
तीसरे कक्ष या M कोश में होगी = 2 × 3^2 = 18
चौथे कक्ष या N कोश में होगी = 2 × 4^2 = 32
( ii ) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है ।
( iii ) किसी परमाणु के दिए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते । इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं ।
प्रश्न 7. सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए ।
उत्तर - परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है , वही उस तत्व की संयोजकता - शक्ति अर्थात् संयोजकता होती है । संयोजकता परमाणु की संयोजन शक्ति है सिलिकॉन ( Si ) का इलेक्ट्रॉनिक विन्यास 2,8,4 है ।
अत : सिलिकॉन की संयोजकता 4 होगी क्योंकि उसे अष्टक पूर्ण करने के लिए 4 इलेक्ट्रॉन साझा करने पड़ेंगे । ऑक्सीजन ( O ) का इलेक्ट्रॉनिक विन्यास 2 , 6 है । अतः ऑक्सीजन की संयोजकता 2 होगी क्योंकि उसे अपना अष्टक बनाने के लिए 2 इलेक्ट्रॉन लेने पड़ेंगे ।
प्रश्न 8. उदाहरण के साथ व्याख्या कीजिए - परमाणु संख्या , द्रव्यमान संख्या , समस्थानिक और समभारिक । समस्थानिकों के कोई दो उपयोग लिखिए ।
उत्तर - परमाणु संख्या - एक परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु कहते हैं । इसे Z के द्वारा दर्शाया जाता है । किसी तत्व के सभी अणुओं की परमाणु संख्या ( Z ) समान होती है ।
हाइड्रोजन के लिए Z = 1 , क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है ।
द्रव्यमान संख्या - एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है । उदाहरण के लिए कार्बन का द्रव्यमान 12u है क्योंकि इसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं , 6 u + 6u = 12। इसी प्रकार ऐलुमिनियम का द्रव्यमान 27 u है ( 13 प्रोटॉन + 14 न्यूट्रॉन ) ।
समस्थानिक - समस्थानिक एक ही तत्त्व के परमाणु होते हैं जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है।
उदाहरण के लिए , हाइड्रोजन परमाणु की तीन परमाण्विक स्पीशीज होती हैं - प्रोटियम , H ड्यूटीरियम ( H या D ) ट्राइटियम H या T ) । प्रत्येक की परमाणु संख्या समान है लेकिन द्रव्यमान संख्या क्रमश : 1.2 और 3 है ।
समभारिक - समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न - भिन्न होती है । दो तत्वों - कैल्शियम , परमाणु संख्या 20 और आर्गन परमाणु संख्या में परमाणु संख्या भिन्न है लेकिन उनकी द्रव्यमान संख्या 40 यानि कि समान है ।
समस्थानिकों के अनुप्रयोग-
( 1 ) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी ( atomic reactor ) में ईंधन के रूप में होता है ।
( 2 ) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है ।
प्रश्न 9. Na+ के पूरी तरह भरे हुए K व L कोश होते है - व्याख्या कीजिए ।
उत्तर - सोडियम Na की परमाणु संख्या 11 है । अत : Na में 11 इलेक्ट्रॉन हैं व उसका इलेक्ट्रॉनिक विन्यास 2 , 8 , 1 है ।
किन्तु Na+ में 10 इलेक्ट्रॉन होते हैं । 10 में से K कक्ष में 2 व L कक्ष में 8 इलेक्ट्रॉन होंगे । अत : Na+ के पूरी तरह भरे हुए K व L कोश होते हैं ।
प्रश्न 10. अगर ब्रोमीन परमाणु दो समस्थानिकों 7935Br (49.7%) तथा 8135Br (50.3%) के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर:
प्रश्न 11. एक तत्व X का परमाणु द्रव्यमान 16.2 u है तो इसके किसी एक नमूने में समस्थानिक 168X और 188X का प्रतिशत क्या होगा?
उत्तर:
प्रश्न 12. यदि तत्व का Z = हो तो तत्व की संयोजकता क्या होगी ? तत्व का नाम भी लिखिए ।
उत्तर- Z = 3 का तात्पर्य है कि तत्व की परमाणु संख्या है , तो उसका इलेक्ट्रॉनिक विन्यास 2, 1 होगा । अत : तत्व की संयोजकता 1 है ( क्योंकि उसके बाहरी कक्ष में 1 इलेक्ट्रॉन है । ) अत : Z = 3 वाला तत्व लीथियम है ।
प्रश्न 13. दो परमाणु स्पीशीज के केन्द्रकों का संघटन नीचे दिया गया है
X Y
प्रोटॉन 6 6
न्यूट्रॉन 6 8
X और Y की द्रव्यमान संख्या ज्ञात कीजिए । इन दोनों स्पीशीज में क्या संबंध है ?
उत्तर- X की द्रव्यमान संख्या = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या = 6 + 6 = 12
Y की द्रव्यमान संख्या = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या = 6 + 8 = 14
इन दोनों परमाणु स्पीशीज में परमाणु संख्या समान है । परन्तु द्रव्यमान संख्या भिन्न है । अतः ये समस्थानिक हैं ।
प्रश्न 14: निम्नलिखित में से सही और गलत पहचानो
- जे जे टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
- एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित रहता है।
- इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 1/2000 गुणा होता है।
- आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर: (1) F, (2) F, (3) T, (4) T
प्रश्न 15: रदरफोर्ड के अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था:
- परमाणु केंद्रक
- इलेक्ट्रॉन
- प्रोटॉन
- न्यूट्रॉन
उत्तर: (3) प्रोटॉन
प्रश्न 16: एक तत्व के समस्थानिक में होते हैं:
- समान भौतिक गुण
- भिन्न रासायनिक गुण
- न्यूट्रॉनों की अलग-अलग संख्या
- भिन्न परमाणु संख्या
उत्तर: (3) न्यूट्रॉनों की अलग-अलग संख्या
प्रश्न 17: Cl- आयन में संयोजकता इलेक्ट्रॉनों की संख्या है:
- 16
- 8
- 17
- 18
प्रश्न 18: सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में से कौन है?
- 2, 8
- 8, 2, 1
- 2, 1, 8
- 2, 8, 1
उत्तर: (4) 2, 8, 1
NCERT Solution Variousinfo
तो दोस्तों, कैसी लगी आपको हमारी यह पोस्ट ! इसे अपने दोस्तों के साथ शेयर करना न भूलें, Sharing Button पोस्ट के निचे है। इसके अलावे अगर बिच में कोई समस्या आती है तो Comment Box में पूछने में जरा सा भी संकोच न करें। अगर आप चाहें तो अपना सवाल हमारे ईमेल Personal Contact Form को भर पर भी भेज सकते हैं। हमें आपकी सहायता करके ख़ुशी होगी । इससे सम्बंधित और ढेर सारे पोस्ट हम आगे लिखते रहेगें । इसलिए हमारे ब्लॉग “NCERT Solution Variousinfo” को अपने मोबाइल या कंप्यूटर में Bookmark (Ctrl + D) करना न भूलें तथा सभी पोस्ट अपने Email में पाने के लिए हमें अभी Subscribe करें। अगर ये पोस्ट आपको अच्छी लगी तो इसे अपने दोस्तों के साथ शेयर करना न भूलें। आप इसे whatsapp , Facebook या Twitter जैसे सोशल नेट्वर्किंग साइट्स पर शेयर करके इसे और लोगों तक पहुचाने में हमारी मदद करें। धन्यवाद !
Related Searches
Ncert solution Class 9 Science Chapter 4 Question answer in Hindi Class 9 Science Chapter 4 Extra Questions and Answers NCERT Class 9 Science Chapter 4 PDF download , CH 4 Science Class 9 Notes PDF Q Class 9 Chapter 4 Atoms and Molecules Class 9 Worksheet with Answers 9th class Science chapter 4 , NCERT Solutions for Class 9 Science Chapter 4 in hindi solution







0 Response to "Class 9th science notes chapter 4 Structure of The Atom (परमाणु की संरचना)"
Post a Comment